Bauchspeicheldrüsenkrebs: Verdopplung von Genen macht Tumore so aggressiv
Bauchspeicheldrüsenkrebs zählt zu den Krebserkrankungen mit der weltweit höchsten Sterblichkeit. Genetische Veränderungen, mit der sich die besondere Aggressivität und frühe Metastasierung dieser Krebsform erklären ließe, konnten bisher allerdings nicht gefunden werden. Ein Forschungsteam des Deutschen Krebskonsortiums (DKTK) und der Technischen Universität München (TUM) zeigt jetzt, dass diese Eigenschaften durch bestimmte Gen-Vervielfältigungen, die entlang unterschiedlicher Evolutionswege des Krebses entstehen, erklärt werden können. Aus dieser Entdeckung leiten sie grundlegende Prinzipien für die Biologie dieser Krebsart ab.
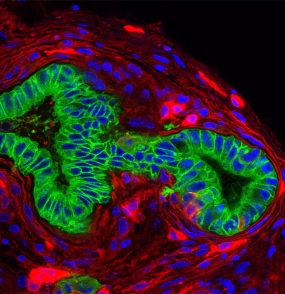
Pankreaskarzinom (grün) in einer Mauslinie mit mutiertem Kras-Gen. In rot sind Zellen des Tumormikromilieus (Fibroblasten, Immunzellen, Endothelzellen) zu sehen.
© Dieter Saur/ TUM
Bisher scheiterten Wissenschaftlerinnen und Wissenschaftler daran, Eigenschaften des Bauchspeicheldrüsenkrebses, wie dessen Aggressivität, mit Veränderungen im Erbgut des Tumors, so genannten Mutationen, in Zusammenhang zu bringen. Zudem bildet Bauchspeicheldrüsenkrebs sehr viel schneller Metastasen als andere Krebsarten. Auch hier sind die genetischen Ursachen bisher unklar.
Ein Team um Prof. Dieter Saur vom Deutschen Krebskonsortium (DKTK) und Prof. Roland Rad TUM Universitätsklinikum rechts der Isar und DKTK, ist beiden Problemen einen entscheidenden Schritt nähergekommen. Mit Hilfe verschiedener Mausmodelle zur Erforschung des Bauchspeicheldrüsenkrebses gelang es ihnen, molekulare Wege der Tumorentstehung im Detail aufzudecken. Sie können so nachvollziehen, wie unterschiedliche Eigenschaften der Erkrankung entstehen. Die Studie wurde im Fachjournal Nature veröffentlicht.
Tumorzellen besitzen mehrere fehlerhafte Kopien eines Krebsgens
Gesunde Zellen in Menschen haben von jedem Gen zwei Kopien. Für ihre Experimente mutierten die Forscherinnen und Forscher eine der beiden Kopien des Kras-Gens in Mäusen. Das Gen spielt bei der Zellvermehrung eine wichtige Rolle und ist in 90% aller menschlichen Bauchspeicheldrüsentumore aktiviert. Solche Gene werden auch als Krebsgene oder Onkogene bezeichnet. Dabei machte das Team um Roland Rad eine überraschende Entdeckung: Das mutierte Gen wurde häufig bereits in sehr frühen Vorstufen des Krebses vervielfältigt. Hatte ein Tumor die mutierte Kras-Genkopie nicht verdoppelt, entdeckten die Forscher Vervielfältigungen in anderen Krebsgenen.
„Es scheint so als müsste die Zelle das Wachstumssignal durch die zusätzlichen Gen-Kopien erhöhen. Dieses Modell der Dosisverstärkung während der Tumorentwicklung wurde bisher nicht berücksichtigt", sagt Sebastian Müller, Erstautor der Studie, und fügt hinzu: „Wir konnten zusätzlich zeigen, dass bei erhöhter Zahl der mutierten Kras-Kopien die Aggressivität und die Fähigkeit zur Metastasierung zunahmen."
Störung körpereigener Schutzmechanismen bestimmt die Evolution des Krebses
Normalerweise haben gesunde Zellen eigene Schutzmechanismen, damit sich Mutationen nicht anhäufen. Warum konnten die Zellen also diese Dosisverstärkung überhaupt schaffen, ohne daran gehindert zu werden?
„Hier zeigt sich die Bedeutung von Mausmodellen. Sie ermöglichen uns, die außerordentlich komplexen Prozesse der molekularen Krebsentwicklung umfassend zu beobachten und experimentell zu überprüfen: von der gesunden Zelle über Krebsvorläufer bis hin zum aggressiven Tumor und dessen Ausbreitung in verschiedene Organe", erklärt Prof. Dieter Saur.
Nach der durch die Forscher verursachten Kras-Mutation entstanden zunächst weitere Mutationen in so genannten Tumorsuppressorgenen. Damit die Entwicklung einer Tumorzelle verhindert wird, besitzt eine gesunde Zelle eine ganze Reihe solcher schützender Gene. Eine grundlegende Erkenntnis der Forscher war: Je nachdem welches Tumorsuppressorgen betroffen war und wie stark dessen Funktion beeinträchtigt wurde, wird entweder das mutierte Kras-Gen oder ein anderes Krebsgen vervielfältigt.
Die Wichtigsten Entwicklungsschritte aufgeklärt
Erst durch das Ausschalten der zelleigenen Schutzmechanismen und die darauffolgende ‚Dosisverstärkung' kann am Ende ein Tumor entstehen. Welchen Weg die Zelle dabei einschlägt und welche Gene beteiligt sind, bestimmte dann maßgeblich die Eigenschaften des Bauchspeicheldrüsentumors.
Durch das Modell der ‚Dosisverstärkung' lassen sich erstmals genetische Muster festlegen, die dessen Aggressivität und Metastasierung erklären. „Wir haben Hinweise darauf, dass unsere Entdeckung ein grundlegendes Prinzip bei der Entstehung von Tumoren darstellt und auch bei anderen Krebsarten von Bedeutung ist. Wir gehen nun der Frage nach, inwieweit diese neuen Einblicke in die Tumorbiologie für die Entwicklung neuer Therapiestrategien genutzt werden können", erklärt Prof. Roland Rad die nächsten Forschungsziele.
---
Beteiligte Institutionen: Technische Universität München (Zentralinstitut für Translationale Krebsforschung TranslaTUM, II. Medizinische Klinik, und Institut für Pathologie des Klinikums rechts der Isar); DKTK und DKZF Heidelberg;The Wellcome Trust Sanger Institute, Cambridge; Ludwig-Maximilians Universität (Anthropology & Human Genomics und Innere Medizin II des Klinikums Großhadern), Helmholtz Zentrum München (Research Unit Radiation Cytogenetics); Universidad de Oviedo (Bioquímica y Biología Molecular, IUOPA und CINN-CSIC), Instituto de Medicina Oncológica y Molecular de Asturias (IMOMA), Oviedo, University of Cambridge (Department of Veterinary Medicine), Instituto de Medicina Oncológica y Molecular de Asturias, Instituto de Biomedicina y Biotecnología de Cantabria
S. Mueller, T. Engleitner, R. Maresch, M. Zukowska, S. Lange, T. Kaltenbacher, B. Konukiewitz, R. Öllinger, M. Zwiebel, A. Strong, H.-Y. Yen, R. Banerjee, S. Louzada, B. Fu, B. Seidler, J. Götzfried, K. Schuck, Z. Hassan, A. Arbeiter, N. Schönhuber, S. Klein, C. Veltkamp, M. Friedrich, L. Rad, M. Barenboim, C. Ziegenhain, J. Hess, O. M. Dovey, S. Eser, S. Parekh, F. Constantino-Casas, J. de la Rosa, M. I. Sierra, M. Fraga, J. Mayerle, G. Klöppel, J. Cadiñanos, P. Liu, G. Vassiliou, W. Weichert, K. Steiger, W. Enard, R. M. Schmid, F. Yang, K. Unger, G. Schneider, I. Varela, A. Bradley, D. Saur, R. Rad, Evolutionary routes and KRAS dosage define pancreatic cancer phenotypes, Nature, 2017, DOI: 10.1038/nature25459
https://www.nature.com/articles/nature25459
Ein Bild zur Pressemitteilung steht zum Download zur Verfügung unter:
www.dkfz.de/de/presse/pressemitteilungen/2018/mPDAC.jpg
BU: Pankreaskarzinom (grün) in einer Mauslinie mit mutiertem Kras-Gen. In rot sind Zellen des Tumormikromilieus (Fibroblasten, Immunzellen, Endothelzellen) zu sehen.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Bitte geben Sie als Bildnachweis an: „Quelle: Dieter Saur/ TUM".
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Beim Krebsinformationsdienst (KID) des DKFZ erhalten Betroffene, Interessierte und Fachkreise individuelle Antworten auf alle Fragen zum Thema Krebs.
Um vielversprechende Ansätze aus der Krebsforschung in die Klinik zu übertragen und so die Chancen von Patientinnen und Patienten zu verbessern, betreibt das DKFZ gemeinsam mit exzellenten Universitätskliniken und Forschungseinrichtungen in ganz Deutschland Translationszentren:
Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft Deutscher Forschungszentren.
