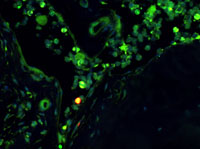
The adult bone marrow harbors a reservoir of dormant HSCs. Although dormant HSCs do not contribute to the day-to day generation of new blood cells, they are efficiently and reversibly activated in response to bone marrow stress induced, for example, by chemotherapeutic agents or toxic substances (such as BrdU).
© dkfz.de
Normale Stammzellen haben ebenso wie Krebszellen die Fähigkeit lebenslanger Selbsterneuerung. Diese Selbsterneuerung ist ein physiologischer Mechanismus, der einen kleinen Bestand von Stammzellen aufrechterhält, die sich unendlich teilen können, aber gleichzeitig in der Lage sind, eine Vielfalt von differenzierten Zellen zu erzeugen, die die Funktionen des Körper aufrechterhalten. Unsere Arbeitsgruppe befasst sich mit der molekularen und zellulären Kontrolle der Selbsterneuerung und Differenzierung von adulten Stammzellen, sowie der Erforschung des komplexen Zusammenspiels zwischen Stammzellen und ihrer Mikroumgebung, den Stammzellnischen. Ein weiterer Schwerpunkt liegt auf der Erforschung von Krebs- und Metastasen- Stammzellen im Mausmodell sowie in Krebspatienten. Dieses Feld hat sich zu einem der faszinierendsten Gebiete moderner Krebsforschung entwickelt.
Professor Andreas Trumpp ist gleichzeitig Geschäftsführer des “Heidelberger Instituts für Stammzelltechnologie und Experimentelle Medizin” (HI-STEM gGmbH) einer “public private partnership” zwischen dem DKFZ und der Dietmar Hopp Stiftung (Link: www.hi-stem.de), Ko-Direktor der DKFZ-ZMBH Allianz (Link: www.dkfz-zmbh-allianz.de) und Mitglied des Direktoriums des NCT (Link:www.nct-heidelberg.de).
Überblick unserer wichtigsten Arbeiten an embryonalen (ESCs) und hematopoietischen (HSCs) Stammzellen:
• Identifizierung, Isolierung und Charakterisierung von „schlafenden Blutstammzellen“ im Knochenmark (Wilson et al., Cell, 2008)
• IFN-alpha induziert die Aktivierung von schlafenden Blutstammzellen und macht sie sensitiv für Chemotherapien (Essers et al., Nature, 2009).
• Modell für sequentielle Therapien um ruhende Krebsstammzellen abzutöten (Trumpp et al., Nature Reviews Immunology 2010).
• Genomweite Multi-Omics Analyse (DNA Methylom, Transkriptom, Proteom) von gereinigten HSCs und vier Vorläuferzelltypen zur Identifizierung globaler Prinzipien der Stammzellidentität und Selbsterneuerung (1, cover story).
• In einer kürzlich in CELL veröffentlichten Arbeit, konnten wir zeigen, dass der Schlafstatus von Stammzellen im Blut sowie in pluripotenten embryonalen Stammzellen durch das Krebsgen Myc kontrolliert wird. Interessanterweise wird hier der Metabolismus und Energiehaushalt von der Regulation der Pluripotenz entkoppelt und dadurch der Vorgang der Selbsterneuerung in einen Myc-abhängigen und einen Myc –unabhängigen Prozess aufgespalten (2)
Überblick unserer wichtigsten Arbeiten an Krebs- und Metastasen Stammzellen und Therapie Resistenz:
• Identifizierung und Isolierung von Metastasen-induzierenden Stammzellen direkt aus dem Blut von Brustkrebspatientinnen. Diese Metastasen-Stammzellen bilden Metastasen in Knochen und Leber und werden durch mehrere Rezeptoren an der Oberfläche kontrolliert (CD44+CD47+MET+), die mit einer schlechten Prognose assoziiert sind und durch neuartige Substanzen, die bei mehreren Pharmaunternehmen in der Entwicklung sind, möglicherweise effizient gehemmt werden können (3) und (Baccelli et al. Oncotarget 2014). Zusammenarbeit mit Prof. Andreas Schneeweiss, Universitätsklinikum und NCT Heidelberg.
• Identifizierung von malignen Stammzellen (Lin-CD34+CD38-) aus Patienten mit Myelodysplastischen Syndrom (MDS). Weiterhin konnten wir zeigen, dass MDS Zellen ihre Mikroumgebung im Knochenmark so umprogrammieren, dass eine MDS-Stammzell-Nischen Einheit entsteht die für den Fortschritt der Krankheit verantwortlich ist (Medyouf et al., Cell Stem Cell 2014). Zusammenarbeit mit Prof. Wolf-Karsten Hofmann, Universitätsklinikum Mannheim.
• Für den Bauchspeicheldrüsenkrebs haben wir kürzlich drei unterschiedliche Subtypen beschrieben und Marker entwickelt um Patienten einer der drei Klassen zuzuordnen. Die Subtypen zeigen nicht nur stark unterschiedliche Überlebensprognosen sondern reagieren auch verschieden auf die unterschiedlichen Therapien. Der Exokrine Subtyp produziert große Mengen des Enzyms Cyp3A5, welches Paclitaxel und Typrosin-Kinase Inhibitoren intrazellulär abbaut und dadurch inaktiviert. CYP3A5 ist auch für die erworbene Resistenz gegenüber diesen Medikamenten verantwortlich und wahrscheinlich ist dieser Resistenzmechanismus auch in vielen anderen Karzinomen aktiv. Wir planen nun effiziente Cyp3A5 Inhibitoren zu generieren, mit dem Ziel auch resistente Krebszellen effizient angreifen zu können (4).
Die wichtigsten Publikationen
(1.) Cabezas- Wallscheid et al., (2014). Identification of regulatory networks in HSCs and their immediate progeny via integrated proteome, transcriptome and DNA methylome analysis. Cell Stem Cell, Oct 2;15(4):507-22. (Cover story) (Link to Press Release)
(2.) Scognamiglio et al., (2016). Myc Depletion Induces a Pluripotent Dormant State Mimicking Diapause. Cell, Feb 11;164(4):668-80 (Cover story) (Link to Press Release)
(3.) Baccelli I. et al. (2013). Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay. Nature Biotechnology, 31, 539–544. (Link to Press Release)
(4.) Noll et al., (2016). CYP3A5 mediates basal and acquired therapy resistance in different subtypes of pancreatic ductal adenocarcinoma. Nature Medicine, Mar;22(3):278-87. (Link to Press Release)
