Abteilung Virus-assoziierte Karzinogenese
Prof. Dr. Dr. h. c. Ralf Bartenschlager
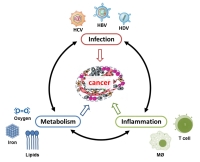
Chronische Infektionen mit dem Hepatitis-B-Virus (HBV), dem Hepatitis-D-Virus (HDV) und dem Hepatitis-C-Virus (HCV) führen zu einer chronischen Entzündung der Leber, die durch angeborene und adaptive Immunreaktionen ausgelöst wird. Darüber hinaus verändern diese Viren die Homöostase der Wirtszellen, insbesondere den Stoffwechsel der infizierten Zellen. Umgekehrt hat der Stoffwechselzustand der Zelle/des Wirts tiefgreifende Auswirkungen auf den Ausgang der Infektion und letztlich auf die Krebsentwicklung.
© dkfz.de
Unsere Abteilung wurde im März 2014 gegründet, um die Mechanismen der Tumorbildung bei viralen Infektionen zu untersuchen. Dabei liegt der Schwerpunkt auf Leberkrebs, welcher weltweit eine der häufigsten Ursachen für krebsbedingte Todesfälle ist. Etwa 75% aller an Leberkrebs erkrankten Patienten sind mit dem Hepatitis-B-Virus (HBV) oder dem Hepatitis-C-Virus (HCV) infiziert. Dementsprechend ist der Leberkrebs ein Beispiel für eine Tumorart, die in hohem Maße mit Virusinfektionen assoziiert ist. Sie ist medizinisch hoch relevant, da weltweit ca. 230 Millionen Menschen mit HBV und ca. 130 Millionen mit HCV infiziert sind. Die Wahrscheinlichkeit, dass sich bei diesen Personen ein Lebertumor entwickelt, wird durch vielfältige Faktoren begünstigt, wobei Stoffwechselstörungen, Alkoholmissbrauch oder chronische Entzündungen eine wesentliche Rolle spielen. Da die Behandlung von Lebertumoren derzeit nur begrenzt möglich ist, besteht ein dringender Bedarf an verbesserten Therapieansätzen sowie sensitiven diagnostischen Verfahren.
Gemeinsam mit unserer Schwester-Abteilung „Molekulare Virologie“ an der Universitätsklinik Heidelberg wurde bereits der Grundstein zur Erforschung von HBV, HCV und Dengue Viren gelegt und ein führendes Zentrum im Bereich der viralen Grundlagenforschung geschaffen. Angesichts der Ähnlichkeiten in wichtigen zellbiologischen Aspekten haben wir außerdem Studien zum Replikationszyklus des Schweren Akuten Respiratorischen Syndroms Coronavirus-2 (SARS-CoV-2) mit dem Ziel integriert, umfassend wirksame antivirale Medikamente zu entwickeln.
Aufbauend auf dieser Expertise forschen wir in der Abteilung "Virus-assoziierte Karzinogenese" am Deutschen Krebsforschungszentrum zu folgenden Schwerpunkten:
- Die Mechanismen, wie persistente Hepatitis-Virusinfektionen entstehen, wie eine chronische Infektion zur Entwicklung von Leberkrebs beiträgt und wie neuartige Konzepte zur Unterbrechung der viralen Persistenz entwickelt werden können, um das Krebsrisiko zu verringern
- Die grundlegenden Prinzipien, wie Virusinfektionen erkannt werden, wie Viren diese antiviralen Strategien überwinden und welche Rolle die zelleigene antivirale Signalübertragung bei der Tumorentwicklung und -therapie spielt
- Die Rolle von eisenregulatorischen Netzwerken bei der infektions- und entzündungsbedingten Bildung von Lebertumoren
- Die Etablierung eines Portfolios onkolytischer Parvoviren und der Analyse der Wechselwirkungen zwischen Virus und Wirtszelle im Zusammenhang mit virusinduzierten Zellstörungen
- Im Zuge der COVID-19-Pandemie wurde das von der Helmholtz-Gesellschaft geförderte Forschungsnetzwerk „CoViPa“ eingerichtet, das die virologischen und immunologischen Determinanten der COVID-19-Pathogenese entschlüsseln und die gewonnenen Erkenntnisse nutzen soll, um besser auf künftige Pandemien vorbereitet zu sein. Weitere Einzelheiten finden Sie unter https://www.dkfz.de/en/covipa/covipa.html
Arbeitsgruppe Ralf Bartenschlager
Arbeitsgruppe Marco Binder
Arbeitsgruppe Bruno Galy
Arbeitsgruppe Jürg Nüesch
Arbeitsgruppe Stefan Seitz
CoViPa Forschungsnetzwerk

