Nachwuchsgruppe Tumorprogression und Metastasierung
Dr. Rene-Filip Jackstadt
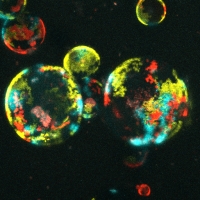
Immunfluoreszenz-Aufnahme von mehrfarbig markierten Organoiden zur Untersuchung der klonalen Dynamik während der Tumorprogression und Metastasierung.
© dkfz.de
Die Metastasierung von Primärtumoren ist mit ca. 90% die Haupttodesursache bei soliden Tumoren. Aus diesem Grund versuchen wir die Mechanismen der Tumorprogression und Metastasierung genau zu verstehen. Die Metastasierung ist ein komplexer Prozess, währenddessen Primärtumorzellen in entfernte Organe einwandern. Jeder Schritt der Metastasierung erhöht die Heterogenität des Tumors und fördert die Tumorstammzelleigenschaften. Diese Tumorstammzellen haben spezielle molekulare, genetische und phänotypische Eigenschaften, welche das Risiko der Therapieresistenz erhöhen. Hierbei kann das Tumor-Mikromilieu jedoch die phänotypische Plastizität der Tumorstammzellen kontrollieren.
Wir verwenden Multi-Omics Technologien wie Einzelzellsequenzierung (Transkriptom, Epigenom, Methylom), funktionelle genomische Analysen und Zellverfolgungsansätze, um die Tumorstammzellplastizität in komplexen in vivo Modellen zu untersuchen. Diese Mausmodelle verfügen über genetische Veränderungen und zeigen einen Progressionsverlauf, wie er bei Darmkrebspatienten beobachtet wird. Des Weiteren erlauben uns diese Modelle, die Tumorprogression im nativen Tumor-Mikromilieu zu untersuchen, wodurch wir die Rolle von Zell-extrinsischen Faktoren auf die Tumorstammzelleigenschaften im Zuge der Metastasierung analysieren können. Unsere ausgeprägte Expertise in der Nutzung von genetischen Mausmodellen ermöglicht uns, jeden Schritt der Tumorprogression sowie die Therapie-bedingten Veränderungen zu untersuchen. Zusätzlich verwenden wir Frischgewebe und generieren Organoide von Patienten, um die tödlichsten Stadien dieser Krankheit zu verstehen.
Um die Mechanismen der Darmkrebsprogression zu verstehen, konzentriert sich unsere künftige Forschungsarbeit auf die folgenden drei Themen:
- Die funktionelle Charakterisierung von Tumorstammzellen in der Tumorevolution
- Die molekulare und zelluläre Basis der Tumorstammzellnische
- Analysen von Tumorstammzellen und deren Interaktion mit dem Tumor-Mikromilieu als potenzieller Mechanismus für Therapieresistenzen

