
Aggressiv oder kommunikativ?
Oxidantien, darunter auch die sogenannten „freien Radikale", sind schädlich – Antioxidantien fangen diese ab, entschärfen die Übeltäter und dienen damit der Gesundheit. So liest man es häufig. Kein Wunder: Manche reaktive Sauerstoffverbindungen können Zellbestandteile und das Erbgut schädigen und dadurch potenziell Krebs auslösen. Doch ganz so einfach ist die Sache nicht. Denn hinter den reaktiven Sauerstoffverbindungen steckt weit mehr als landläufig angenommen. Sie sind wichtige Bestandteile der Kommunikation innerhalb der Zelle. „Endogene Oxidantien, die natürlicherweise im Rahmen des Stoffwechsels entstehen, insbesondere Wasserstoffperoxid, dienen gesunden Zellen als Botenstoffe und spielen daher eine wichtige regulatorische Rolle", sagt Tobias Dick. Als Leiter der Abteilung Redoxregulation geht er mit seinem Team dieser besonderen Funktion der endogenen Oxidantien auf den Grund. Und er untersucht, welche Bedeutung sie möglicherweise für die Krebsmedizin haben.

Tobias P. Dick studierte Biochemie an der Freien Universität Berlin und wurde 1997 an der Universität Tübingen promoviert. Anschließend forschte er fünf Jahre im Howard Hughes Medical Institute an der Yale Universität in New Haven, USA. Im Jahr 2003 übernahm Dick am DKFZ die Leitung der Nachwuchsgruppe Redoxregulation, die 2010 in eine Abteilung überführt wurde.
© dkfz.de
Tobias Dick hatte sich ursprünglich mit einem ganz anderen Thema beschäftigt – nämlich mit dem Immunsystem. Dabei stellte er fest, dass endogene Oxidantien und sogenannte Redoxreaktionen für die körpereigene Abwehr eine wichtige regulatorische Rolle spielen können. Bei Redoxreaktionen werden Elektronen von einem Reaktionspartner auf den anderen übertragen. Dabei werden reaktive Sauerstoffspezies entweder gebildet, also der Sauerstoff in einen reaktionsfreudigen Zustand versetzt, oder durch weitere Elektronenübertragungen wieder entschärft. „Ich wollte wissen, ob solche Reaktionen möglicherweise auch für andere regulatorische Vorgänge in der Zelle eine Rolle spielen", sagt Dick. Damit hatte er sein neues Forschungsfeld gefunden, dem er bis heute treu geblieben ist.
Kommunikative Oxidantien
Tatsächlich hat sich herausgestellt, dass Redoxreaktionen als regulatorische Mechanismen ein weit verbreitetes Phänomen in den Zellen des Körpers sind. Und die reaktiven Sauerstoffspezies bedeuten bei weitem nicht nur Gefahr und Schaden für den Körper. Sie sindForschungwichtige Kommunikatoren und dienen der Zelle etwa als Indikator dafür, wie effizient ein Stoffwechselweg abläuft und ob er eher angekurbelt oder herunterreguliert werden muss.
„Nehmen wir zum Beispiel Wasserstoffperoxid, also H2O2", sagt der Biochemiker Dick. H2O2 kennen viele als Desinfektions- oder Bleichmittel, das etwa beim Friseur zum Einsatz kommt, um Haare zu blondieren. Aber Wasserstoffperoxid ist viel mehr als das: „H2O2 ist ein natürliches Molekül, das bei vielen Stoffwechselprozessen als zusätzliches Produkt entsteht." Unter anderem bildet sich H2O2 bei der Zellatmung, einem zentralen Stoffwechselweg, über den Zellen Energie gewinnen. H2O2 entsteht zum Beispiel dann, wenn das Angebot an energiereichen Nahrungsbestandteilen größer ist als der Bedarf an Energie. Das freigesetzte H2O2 verändert die Aktivität der beteiligten Enzyme ganz spezifisch, was dem Ungleichgewicht entgegensteuert. So passen sich Organismus und Zelle dank der oxidativen Signale sehr schnell an sich ständig ändernde Nahrungs- und Umweltbedingungen an.

Das Team der Abteilung Redoxregulation untersucht, welche Rolle endogene Oxidantien wie Wasserstoffperoxid als Botenstoffe spielen. Die Moleküle verändern die Aktivität bestimmter Enzyme und ermöglichen dadurch unter anderem eine schnelle Anpassung an Stressbedingungen.
© Schwerdt/DKFZ
Doch wie erkennt die Zelle, dass H2O2 freigesetzt wird? Und wie genau erfasst die Zelle das molekulare Signal? Tobias Dick hat mit seinem Team herausgefunden, dass hier eine Gruppe von Enzymen entscheidend ist, die bis dahin dafür bekannt war, dass sie Zellen vor Schäden durch Oxidantien schützt: Peroxidasen. Die meisten Peroxidasen entschärfen H2O2 und entfernen es schlicht und einfach aus der Zelle. Weil das Ganze blitzschnell abläuft, waren Wissenschaftler lange nicht davon ausgegangen, dass Moleküle wie Wasserstoffperoxid für die Zelle auch von Nutzen sein könnten. Doch eine bestimmte Sorte von Peroxidasen, die sogenannten Peroxiredoxine, verhält sich anders. Das haben Dick und seine Mitarbeiter an Zellen herausgefunden, bei denen sie die Erbinformation für Peroxiredoxine entfernt hatten. Überraschenderweise führte diese genetische Manipulation nicht dazu, dass sich in den Zellen schädliche Oxidantien ansammelten. Vielmehr war die Oxidation von Signalproteinen verringert – und damit die Weiterleitung zellulärer Signale blockiert.
Peroxiredoxine merzen demnach die reaktiven Moleküle nicht einfach aus, um die Zelle vor unkontrollierter Oxidation zu schützen. Vielmehr übertragen die Enzyme die oxidative Wirkung des H2O2 in kontrollierter und spezifischer Weise auf Signalproteine und schalten diese dadurch in einen aktiven oder inaktiven Zustand – je nach Kontext.
Eine Frage von Raum und Zeit

© Schwerdt/DKFZ
Dick und sein Team wollen es in Zukunft noch genauer wissen: Wie kommt es, dass reaktive Moleküle in der Zelle mal rasch beseitigt werden und mal der Signalübertragung dienen? Warum beeinträchtigen sie manchmal die Gesundheit und sind ihr in einem anderen Zusammenhang zuträglich? Ein wichtiger Schritt, um sich der Antwort auf diese Frage zu nähern war es, endogene Oxidantien in Echtzeit in der Zelle zu beobachten: Wann und wo entstehen sie? Welchen Weg gehen sie? Welche Enzyme kümmern sich um die reaktiven Moleküle?
Die Wissenschaftlerinnen und Wissenschaftler des DKFZ entwickelten dafür eigens ein molekularbiologisches Werkzeug: Sie schleusen Erbinformation in das Genom von Zellen und Versuchstieren ein, sodass diese Biosensoren herstellen, die mit Lichtsignalen anzeigen, ob ganz bestimmte Oxidantien vorhanden sind oder nicht. Damit können die Forscher genau beobachten, wann und wo Oxidantien in der Zelle entstehen. Die Sensoren sind so empfindlich, dass sich sogar nachvollziehen lässt, wie die Produktion von Oxidantien mit den Bedingungen schwankt – etwa bei körperlicher Aktivität oder nach einer Ernährungsumstellung. Die neueste Generation ihrer Biosensoren erlaubt den Forschern sogar zu verfolgen, wie sich Oxidantien innerhalb einer Zelle zwischen verschiedenen Strukturen bewegen.
„Dadurch ergibt sich ein völlig neues Bild von dem, was in der Zelle abläuft", sagt Dick. Bisher waren Experten davon ausgegangen, dass sich die kleinen Moleküle von ihrem Entstehungsort recht frei in der Zelle verteilen. „Das ist aber nicht der Fall", erklärt der Biochemiker. „Wir haben beobachtet, dass es sich fast immer um sehr lokale Ereignisse in der Zelle handelt." Wenn an einer Stelle, etwa innerhalb eines Enzymkomplexes, H2O2 entsteht, muss das benachbarte Proteinstrukturen noch lange nicht betreffen. Dementsprechend kann dem H2O2 lokal auch eine völlig unterschiedliche Rolle zukommen, je nachdem, wo in der Zelle und in welchem Zusammenhang es entsteht.
Stress im Tumorgewebe
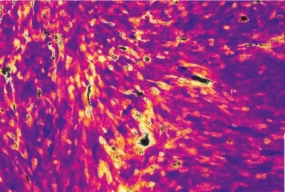
Oxidantienbildung in der Leber: Auf einem Gewebeschnitt macht ein selbst entwickelter Biosensor sichtbar, wann und wo reaktive Sauerstoffmoleküle entstehen.
© dkfz.de
Wenn Zellen so gut gegen Oxidantien gewappnet sind und diese sogar als Botenstoffe für sich nutzen, welche Rolle spielen die reaktiven Moleküle für die Krebsentstehung? Auch dieser Frage wollen Tobias Dick und sein Team mithilfe der Biosensoren auf den Grund gehen. Die DKFZ-Forscher beobachteten, dass Tumorgewebe häufig unter oxidativen Stress geraten, also eine erhöhte endogene Produktion von H2O2 aufweisen, sich aber auch ständig neu daran anpassen. Es zeigte sich, dass Tumorzellen die Signalwirkung des H2O2 ausnutzen, um ihre allgemeine Widerstandsfähigkeit zu erhöhen. So bewirkt Wasserstoffperoxid, dass Tumorzellen zwischen zwei Stoffwechselwegen umschalten und dann mehr Zucker in antioxidative Kraft verwandeln. Ein erst kürzlich entdecktes Phänomen ist die endogene Bildung sogenannter Persulfide. Sie bremsen Radikal-Kettenreaktionen und schützen so die Integrität gesunder Zellen. Den oft stark gestressten Krebszellen helfen die Persulfide dabei, das Ausmaß der Schäden so weit unter Kontrolle zu halten, dass sie dem Zelltod entgehen können.
Die Forscher planen, auch für Stoffwechselerkrankungen auf Ebene der Oxidantien die Unterschiede zwischen gesund und krank herauszuarbeiten. „Möglicherweise finden wir eines Tages einen Ansatzpunkt, auf der Ebene der Oxidantien und ihrer regulatorischen Funktion in das Krankheitsgeschehen einzugreifen und dies therapeutisch zu nutzen", wagt Dick einen Blick in die Zukunft.
